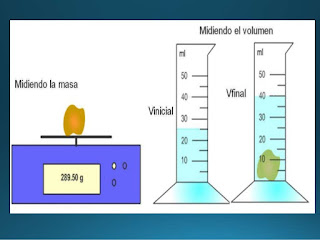
reactivo en exceso es el que reacciona completamente con las demas sustancias pero por gran cantidad , de este queda algun residuio que no reaacionara.
por ejemplo
tenemos una reaccion de aluminio con oxigeno donde nos dan 50gr de Al que reaccionan con 30gr de O2
Al + O2 ----> Al2O
primero debemos balancear la ecuación
4Al + 3 O2 ----> 2 Al2O
luego peso molecular
Al = 27
O = 16 x 2 = 32
tomamos los gramos ya dados
para cada compuesto reactivo
asi:
50gr de Al/27gr de Al = 1,86gr mol
luego 1,86gr mol se multiplica por la cantidad de compuesto formado Al2O asi
1.86gr mol x 2 mol Al2O = 3.72
luego 3.72 se divide por la cantidad de Al que tenia
3.72/4 mol Al = 0.93mol de AlO2
- ahora tomamos el O2 y realizamos el mismo proceso
30gr O2/32gr de O2 = 0.93gr mol
luego 0.93gr mol se multiplica por la cantidad de compuesto formado Al2O asi
0.93gr mol x 2 mol Al2O = 1.86
luego 1.86 se divide por la cantidad de O2 que tenia
1.86/3 mol O2 = 0.62 mol de AlO2
y ahi nos damos cuenta de que
el reativo limite o limitante es el valor menor 0.62 mol de AlO2
correspondiente al O2 el cual sera el que primero se consuma totalmente
y el reactivo en exceso sera 0.93mol de AlO2, que corresponde a Al y sera el que nos sobre
a continuaciòn 1 video con otro ejercicio de reactivo limite en exceso
https://youtu.be/Ul7WDHqx8c4
referencias
http://e-ducativa.catedu.es/44700165/aula/archivos/repositorio/1000/1168/html/3_reactivos_limitante_y_en_exceso.html